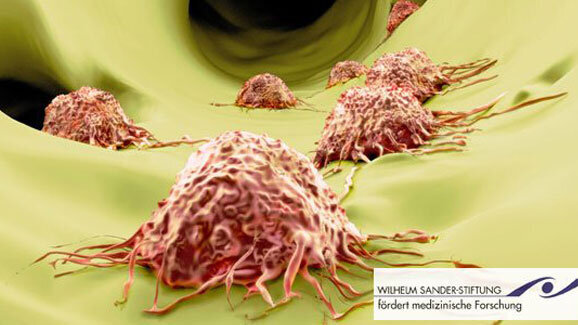
HEIDELBERG - Die Metastasierung ist ein Prozess, an dessen Steuerung eine Vielzahl von Zellkomponenten beteiligt sind. Wissenschaftler untersuchen nun einzelne relevante Teilschritte im Prozess der Metastasierung auf molekularbiologischer Ebene, um übergreifende Zusammenhänge zu verstehen.
Jedes Jahr erkranken allein in Deutschland hunderttausende Menschen an Krebs. Viele Patienten erliegen dieser Krankheit, weil die Tumoren tödliche Tochtergeschwülste (Metastasen) bilden. Eine Forschergruppe aus Heidelberg und Mannheim will zur Aufklärung dieser Metastasierungsvorgänge und deren Regulation maßgeblich beitragen. „Die Metastasierung ist ein vielschichtiger Prozess, an dessen Steuerung verschiedene molekulare Komponenten beteiligt sind. Das Verständnis dieses komplexen Netzwerks ist die Voraussetzung dafür, Krebserkrankungen zukünftig besser und effektiver behandeln zu können“, erläutert Prof. Dr. Heike Allgayer die Motivation des aktuellen Forschungsprojektes.
Während gesunde Körperzellen in ihrer Funktion und Vermehrung strikt vom menschlichen Organismus überwacht werden, entziehen sich Krebszellen dieser Kontrolle. Schlimmer noch: Einige entwickeln die Fähigkeit, den Tumor zu verlassen, in das umgebende Gewebe einzudringen und an anderen Stellen des Körpers Tochtergeschwülste zu bilden. Diese Metastasen machen einen bösartigen Tumor zur lebensbedrohenden Gefahr. Der als Metastasierung bezeichnete Vorgang ist ein Prozess, an dessen Steuerung eine Vielzahl von Zellkomponenten beteiligt sind. Professor Heike Allgayer und ihr Team wollen gemeinsam mit Professor Jonathan Sleeman einzelne relevante Teilschritte im Prozess der Metastasierung auf molekularbiologischer Ebene untersuchen, um die übergreifenden Zusammenhänge zu verstehen. „Wir sind Molekülen auf der Spur, von denen wir annehmen, dass sie die zentralen Komponenten eines Systems bilden, das die Metastasierung von Tumoren im Wesentlichen bestimmt“, erläutert Allgayer.
Langfristiges Ziel des Projektes ist es, den Weg für eine neue Therapie gegen Krebs zu ebnen sowie Kriterien für die Diagnose zu entwickeln. So könnte etwa das Mengenverhältnis bestimmter Moleküle im Gewebe ein Indiz für eine Erkrankung sein. Im Idealfall ließe sich sogar das Stadium der Erkrankung ableiten, so dass Ärzte die Behandlung passgenau gestalten könnten.
Als eine zentrale Stellschraube im Netzwerk hat die Gruppe um Heike Allgayer den molekularen Schalter mit dem sperrigen Namen „Urokinase-Plasminogen-Aktivator-Rezeptor“, kurz: u-PAR, identifiziert. Intensive Vorarbeiten des Forscherteams haben gezeigt, dass u-PAR die Metastasierung fördert, sobald er aktiviert ist und in ausreichend großer Zahl in den Krebszellen auftritt. Im gleichen Zuge haben die Forscher auch die regulierende Wirkung des „Programmierte-Zelltod-Protein 4“ (Pdcd4) aufgedeckt. Pdcd4 hemmt die Metastasierung indem es die Herstellung von u-PAR in den Zellen vermindert. Die Steuerung von Pdcd4 erfolgt wiederum durch eine kurzkettige Ribonukleinsäure, die sogenannte mikro-RNA 21 (miR-21). „Das Fehlen von Pdcd4 in den Zellen – hervorgerufen insbesondere durch die vermehrte Produktion der micro-RNA-21 – ist ein deutlicher Hinweis auf eine Form von Darmkrebs, die gegebenenfalls eher zu Metastasierung neigt“, erläutert Allgayer die für künftige Diagnostik interessanten Ergebnisse.
Aktuelle Untersuchungen der Arbeitsgruppe um Jonathan Sleeman wiesen zudem nach, dass sich die Zellen auf die Metastasierung vorbereiten, indem sie beweglicher werden. Entscheidenden Einfluss darauf hat das Protein CD24 – ein weiterer heißer Kandidat für eine zentrale Komponente im Motor, der die Metastasierung bestimmt. CD24 kommt auf der Oberfläche von Zellen vor und ist an der Signalweiterleitung und Anheftung von Krebszellen beteiligt. Gemeinsam mit der Arbeitsgruppe von Heike Allgayer konnte das Team um Sleemann nachweisen, dass CD24 in der Lage ist, eines der bekanntesten krebsauslösenden Proteine, die Sarcoma (Src)–Kinase, zu aktivieren.
In einem von der Wilhelm Sander-Stiftung geförderten Projekt wollen die Forscher nun das Zusammenspiel zwischen den Molekülen CD24, u-PAR, c-Src, Pdcd4 und miR-21 in Bezug auf die Regulation der Metastasierung von Darmkrebs durch den Einsatz modernster molekularbiologischer Methoden genauer untersuchen. Klären möchte das Forscher-Team, ob und durch welche Mechanismen und Wechselwirkungen die einzelnen Komponenten es bewerkstelligen, die Entstehung und Metastasierung von Darmkrebs zu beeinflussen. Das Verständnis hierfür ist die Voraussetzung, Tumoren zukünftig besser und effektiver behandeln zu können – etwa durch die Entwicklung geeigneter therapeutischer Hemmstoffe.
Bei ihren Analysen greifen die Forscher zum einen auf Zellkulturmodelle zurück, in denen sie die einzelnen Stellschrauben des Motors künstlich herauf-, herunterregulieren oder ganz blockieren. Zum Zweiten nutzen sie auch Gewebeproben, die routinemäßig von Patienten zur Diagnose entnommen werden. Außerdem ergänzen die Forscher diese Daten durch ein Tiermodell, in dem sie das Wachstum von Tumoren in Abhängigkeit von CD24 untersuchen.
Die Wilhelm Sander-Stiftung fördert dieses Forschungsprojekt mit rund 100.000 Euro. Stiftungszweck ist die Förderung der medizinischen Forschung, insbesondere von Projekten im Rahmen der Krebsbekämpfung. Seit Gründung der Stiftung wurden insgesamt über 190 Mio. Euro für die Forschungsförderung in Deutschland und der Schweiz bewilligt. Die Stiftung geht aus dem Nachlass des gleichnamigen Unternehmers hervor, der 1973 verstorben ist.
MELBOURNE, AUSTRALIEN – Schätzungen zufolge leiden mehr als 70 Prozent der Bevölkerung an Parodontitis. Diese Erkrankung des ...
DRESDEN - Ein aktuelles Forschungsergebnis birgt neue Therapieansätze für die Behandlung von Parodontitis: Prof. Triantafyllos Chavakis ...
BERLIN – Einem interdisziplinären Team um Forscher der Charité – Universitätsmedizin Berlin ist es gelungen, die ...
Bangalore – Mit magnetisch gelenkten Nanopartikeln lässt sich die Temperaturempfindlichkeit von Zähnen jetzt dauerhaft beheben. Das neue Verfahren haben...
FREIBURG - Prof. Dr. Dr. h.c. Jörg R. Strub, Ärztlicher Direktor der Abteilung für Zahnärztliche Prothetik am Universitätsklinikum ...
KÖLN – Je nach individuellem Risiko, in der Regel zweimal im Jahr, sollten Patienten eine zusätzliche Unterstützung in Form ...
Freiburg – In den Tiefen eines menschlichen Wurzelkanals haben Forscher*innen des Universitätsklinikums Freiburg ein neues Lebewesen entdeckt. ...
DRESDEN - Forscher des Biotechnologischen Zentrums der TU Dresden entdeckten zusammen mit internationalen Kollegen eine neue Stammzell-Population in den ...
GREIFSWALD - Eine Studie der Uni Greifswald soll Zahnärztinnen und Zahnärzten aufzeigen, wie es um ihre Behandlungserfolge und die Qualität ...
Rochester – Manche Babys knabbern mit sechs Monaten schon sichtbar, andere lassen sich Zeit mit dem Zahnen bis zum ersten Geburtstag. Wann das erste ...
Live-Webinar
Di. 24. Februar 2026
19:00 Uhr CET (Berlin)
Prof. Dr. Markus B. Hürzeler
Live-Webinar
Di. 24. Februar 2026
21:00 Uhr CET (Berlin)
Prof. Dr. Marcel A. Wainwright DDS, PhD
Live-Webinar
Mi. 25. Februar 2026
14:00 Uhr CET (Berlin)
Live-Webinar
Mi. 25. Februar 2026
17:00 Uhr CET (Berlin)
Prof. Dr. Daniel Edelhoff
Live-Webinar
Mi. 25. Februar 2026
19:00 Uhr CET (Berlin)
Live-Webinar
Do. 26. Februar 2026
2:00 Uhr CET (Berlin)
Live-Webinar
Fr. 27. Februar 2026
14:00 Uhr CET (Berlin)



 Österreich / Österreich
Österreich / Österreich
 Bosnien und Herzegowina / Босна и Херцеговина
Bosnien und Herzegowina / Босна и Херцеговина
 Bulgarien / България
Bulgarien / България
 Kroatien / Hrvatska
Kroatien / Hrvatska
 Tschechien & Slowakei / Česká republika & Slovensko
Tschechien & Slowakei / Česká republika & Slovensko
 Frankreich / France
Frankreich / France
 Deutschland / Deutschland
Deutschland / Deutschland
 Griechenland / ΕΛΛΑΔΑ
Griechenland / ΕΛΛΑΔΑ
 Ungarn / Hungary
Ungarn / Hungary
 Italien / Italia
Italien / Italia
 Niederlande / Nederland
Niederlande / Nederland
 Nordic / Nordic
Nordic / Nordic
 Polen / Polska
Polen / Polska
 Portugal / Portugal
Portugal / Portugal
 Rumänien & Moldawien / România & Moldova
Rumänien & Moldawien / România & Moldova
 Slowenien / Slovenija
Slowenien / Slovenija
 Serbien & Montenegro / Србија и Црна Гора
Serbien & Montenegro / Србија и Црна Гора
 Spanien / España
Spanien / España
 Schweiz / Schweiz
Schweiz / Schweiz
 Türkei / Türkiye
Türkei / Türkiye
 Großbritannien und Irland / UK & Ireland
Großbritannien und Irland / UK & Ireland
 International / International
International / International
 Brasilien / Brasil
Brasilien / Brasil
 Kanada / Canada
Kanada / Canada
 Lateinamerika / Latinoamérica
Lateinamerika / Latinoamérica
 USA / USA
USA / USA
 China / 中国
China / 中国
 Indien / भारत गणराज्य
Indien / भारत गणराज्य
 Pakistan / Pākistān
Pakistan / Pākistān
 Vietnam / Việt Nam
Vietnam / Việt Nam
 ASEAN / ASEAN
ASEAN / ASEAN
 Israel / מְדִינַת יִשְׂרָאֵל
Israel / מְדִינַת יִשְׂרָאֵל
 Algerien, Marokko und Tunesien / الجزائر والمغرب وتونس
Algerien, Marokko und Tunesien / الجزائر والمغرب وتونس
 Naher Osten / Middle East
Naher Osten / Middle East




















































To post a reply please login or register