LEIPZIG – 12 Millionen Deutsche leiden an Parodontose. Wird die Entzündung nicht behandelt, droht Zahnverlust. Doch sie steht auch im Verdacht, viele Erkrankungen wie Herz-Kreislaufschädigungen auszulösen. Forscher des EU-Projektes TRIGGER untersuchen nun die Wechselwirkungen und entwickeln Wirkstoffe, um die Parodontose-Erreger zu bekämpfen.
Wenn beim Zähneputzen oder beim Biss in einen Apfel das Zahnfleisch blutet, könnte dies auf eine Parodontitis hindeuten – eine entzündliche Erkrankung des Zahnhalteapparats. Bakterielle Plaque greift den Knochen an, der Zahn kann sich mit der Zeit lockern. Bleibt die Erkrankung unbehandelt, droht Zahnverlust. Die Parodontitis, umgangssprachlich auch Parodontose genannt, ist aber auch ein Krankheitsherd für den gesamten Körper: Gelangen die zum Teil sehr aggressiven Bakterien in den Blutkreislauf, können sie weitere Schäden anrichten. Medizinische Studien belegen Wechselwirkungen zwischen Parodontose-Erregern und verschiedenen Erkrankungen wie Herz-Kreislaufschädigungen, rheumatoider Arthritis und chronisch obstruktiver Lungenerkrankung (COPD). Nachgewiesen ist, dass Betroffene ein erhöhtes Risiko für eine Verengung der Herzkranzgefäße, aber auch für Alzheimer haben.
Laut Weltgesundheitsorganisation (WHO) leiden rund 60 Prozent aller Erwachsenen unter behandlungsbedürftigen Zahnfleischentzündungen, eine bedenklich hohe Zahl. Im EU-Projekt TRIGGER widmen sich elf europäische Forschungsorganisationen aus neun Ländern der Volkskrankheit. Sie untersuchen den Einfluss von Parodontitiserregern auf die genannten Erkrankungen. Ziel ist es, Zusammenhänge zwischen der Parodontose und anderen entzündlichen Erkrankungen zu erklären und nachzuweisen, dass eine effektive Mundhygiene und Behandlung der Parodontose den allgemeinen Gesundheitszustand verbessern kann. Eine besondere Aufgabe im Verbundprojekt hat die Projektgruppe für Molekulare Wirkstoffbiochemie und Therapieentwicklung des Fraunhofer-Instituts für Zelltherapie und Immunologie IZI übernommen: die Forscher der Außenstelle des IZI in Halle/Saale sollen Wirkstoffe entwickeln, mit denen sich die krankhaften Mundkeime effektiv behandeln lassen. Die Hallenser erhalten für diese Aufgabe ein Zehntel des Gesamtförderetats von 7,8 Millionen Euro. Die Kompetenz der Gruppe liegt im Identifizieren pathologischer Mechanismen auf Proteinebene und der Optimierung von Wirkstoffen, basierend auf diesen Erkenntnissen.
„Wir suchen nach Wirkstoffen, um das hochtoxische Bakterium Porphyromonas gingivalis zu bekämpfen. Dieser aggressive Haupterreger bewohnt die Zahnfleischtaschen. Er ist verantwortlich für die Gingivitis, also die Zahnfleischerkrankung im Mund, aus der sich die Parodontose entwickeln kann“, sagt Prof. Dr. Hans-Ulrich Demuth, Leiter und Initiator der Projektgruppe in Halle. Der Protein-Experte führte lange Zeit eine Arbeitsgruppe „Wirkstoffforschung“ an der Martin-Luther-Universität Halle und später am Leibniz-Institut für Naturstoffforschung in Jena. Während seiner Zeit als Vorstand des Biotechnologieunternehmens Probiodrug AG entwickelte sein Team ein heute am Markt befindliches Konzept zur Behandlung von Altersdiabetes.
Porphyromonas gingivalis lebt vom Abbau des Kollagens im Mundbereich. Das Bakterium zerstört das Zahnfleischgewebe, indem es eiweißabbauende Enzyme aktiviert, und zwar kurz bevor sie im Mundbereich freigesetzt werden. Um diesen Mechanismus anzustoßen, nutzt Porphyromonas gingivalis ein spezielles Enzym: die bakterielle Glutaminyl-Zyklase, die an der Proteinreifung beteiligt ist. Dieses Enzym haben die Hallenser Forscher vor Jahren in Säugern charakterisiert und neue Eigenschaften entdeckt. „Es spielt eine essentielle Rolle bei der Immunüberreaktion in Krankheitsbildern und ist bei entzündlichen Krankheiten wie etwa rheumatoider Arthritis, COPD und Alzheimer beteiligt. Es gibt hier offenbar einen grundsätzlichen Zusammenhang zwischen bestimmten bakteriellen Infektionen und verschiedenen entzündlichen Erkrankungen, der noch ungeklärt ist. Wir vermuten, dass die humane Glutaminyl-Zyklase zum Beispiel bei Alzheimer-Patienten eine für Nervenzellen besonders schädliche Variante des Amyloidbeta-Peptids bildet. Ein darauf basierendes Therapieprinzip gegen Alzheimer befindet sich inzwischen in klinischen Prüfungen. Im Fall der Gingivitis kann das Blockieren des bakteriellen Schlüssel-Enzyms den Porphyromonas gingivalis-Erreger verhungern lassen“, erläutert Professor Demuth. Der Biochemiker und sein Team suchen daher nach einem Hemmstoff, der die Aktivität des Enzyms herabsetzt.
Erste Erfolge kann die Hallenser Gruppe bereits vorweisen. Aus einem Paket von 20 Substanzen konnten sie einige hochwirksame Substanzen herausfiltern, die den Keim Porphyromonas gingivalis inzwischen im Zellkulturmodell um 95 Prozent an seinem Wachstum behindern. Demnächst starten tierexperimentelle Arbeiten. Doch bevor ein Präparat gegen Parodontose auf den Markt kommt, bedarf es noch einer Reihe von Maßnahmen. Zunächst steht die Optimierung der Substanzen an, bevor in klinischen Studien getestet werden kann, in welcher Form und Menge der Wirkstoff verabreicht wird. „Das ist ein langwieriger Prozess. Aber um Parodontose zu bekämpfen, reicht eine gute Mundhygiene allein nicht aus. Hier muss man zusätzlich medikamentös eingreifen und so auch verhindern, dass Porphyromonas gingivalis weitere entzündliche Erkrankungen auslöst“, so Demuth.
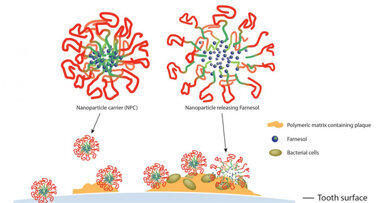
PHILADELPHIA, USA – Der antibakterielle Wirkstoff Farnesol ist ein vielversprechender Helfer im Kampf gegen Plaque, da er die Bildung von ...
PENNSYLVANIA, USA – Biopharmazeutika gehören zu den wirksamsten und wichtigsten Proteinpräparaten auf dem Markt. Solche, die in der ...
JERUSALEM, ISRAEL – Antibiotikaresistente Keime stellen eine zunehmende Bedrohung bei medizinischen und zahnmedizinischen Eingriffen dar. ...
BONN/KREMS – „Mehr Wirtschaftswachstum“ in Europa will die EU-Kommission durch drastischen Abbau von Privilegien der „Freien ...
BERLIN - Die von der Allianz der Ärzteverbände angekündigten Widerstandsmaßnahmen gegen das Machtkartell der gesetzlichen ...
BERLIN – Frühkindliche Karies soll künftig flächendeckend auch im Rahmen des Leistungskataloges der Gesetzlichen ...
LEIPZIG – Von den geschätzten 700 Bakterienspezies in der Mundhöhle sind nur elf als besonders parodontalpathogen bekannt. Der Nachweis der ...
BOCHUM - Sogenannte grampositive Bakterien aus den Zahnfleischtaschen können in Folge zahlreicher zahnärztlicher Eingriffe in die Blutbahn ...
Dr. Lenka Banasova betreibt in der slowakischen Hauptstadt Bratislava ihr eigenes Dentalzentrum namens Pearl Dental, wo ein leidenschaftliches Team aus ...
ULM - Ob Küssen während der Coronavirus-Pandemie zum Risikoverhalten wird, haben Virologinnen und Virologen der Ulmer Universitätsmedizin untersucht. In ...
Live-Webinar
Di. 24. Februar 2026
19:00 Uhr CET (Berlin)
Prof. Dr. Markus B. Hürzeler
Live-Webinar
Di. 24. Februar 2026
21:00 Uhr CET (Berlin)
Prof. Dr. Marcel A. Wainwright DDS, PhD
Live-Webinar
Mi. 25. Februar 2026
14:00 Uhr CET (Berlin)
Live-Webinar
Mi. 25. Februar 2026
17:00 Uhr CET (Berlin)
Prof. Dr. Daniel Edelhoff
Live-Webinar
Mi. 25. Februar 2026
19:00 Uhr CET (Berlin)
Live-Webinar
Do. 26. Februar 2026
2:00 Uhr CET (Berlin)
Live-Webinar
Fr. 27. Februar 2026
14:00 Uhr CET (Berlin)



 Österreich / Österreich
Österreich / Österreich
 Bosnien und Herzegowina / Босна и Херцеговина
Bosnien und Herzegowina / Босна и Херцеговина
 Bulgarien / България
Bulgarien / България
 Kroatien / Hrvatska
Kroatien / Hrvatska
 Tschechien & Slowakei / Česká republika & Slovensko
Tschechien & Slowakei / Česká republika & Slovensko
 Frankreich / France
Frankreich / France
 Deutschland / Deutschland
Deutschland / Deutschland
 Griechenland / ΕΛΛΑΔΑ
Griechenland / ΕΛΛΑΔΑ
 Ungarn / Hungary
Ungarn / Hungary
 Italien / Italia
Italien / Italia
 Niederlande / Nederland
Niederlande / Nederland
 Nordic / Nordic
Nordic / Nordic
 Polen / Polska
Polen / Polska
 Portugal / Portugal
Portugal / Portugal
 Rumänien & Moldawien / România & Moldova
Rumänien & Moldawien / România & Moldova
 Slowenien / Slovenija
Slowenien / Slovenija
 Serbien & Montenegro / Србија и Црна Гора
Serbien & Montenegro / Србија и Црна Гора
 Spanien / España
Spanien / España
 Schweiz / Schweiz
Schweiz / Schweiz
 Türkei / Türkiye
Türkei / Türkiye
 Großbritannien und Irland / UK & Ireland
Großbritannien und Irland / UK & Ireland
 International / International
International / International
 Brasilien / Brasil
Brasilien / Brasil
 Kanada / Canada
Kanada / Canada
 Lateinamerika / Latinoamérica
Lateinamerika / Latinoamérica
 USA / USA
USA / USA
 China / 中国
China / 中国
 Indien / भारत गणराज्य
Indien / भारत गणराज्य
 Pakistan / Pākistān
Pakistan / Pākistān
 Vietnam / Việt Nam
Vietnam / Việt Nam
 ASEAN / ASEAN
ASEAN / ASEAN
 Israel / מְדִינַת יִשְׂרָאֵל
Israel / מְדִינַת יִשְׂרָאֵל
 Algerien, Marokko und Tunesien / الجزائر والمغرب وتونس
Algerien, Marokko und Tunesien / الجزائر والمغرب وتونس
 Naher Osten / Middle East
Naher Osten / Middle East



















































To post a reply please login or register